本文转载自:Lipin 1缺乏相关的成年人发病肌无力,与神经肌肉接头障碍相关
前言:
临床尚有很多罕见疾病,部分是基因变异相关的疾病。
对这些疾病的识别,既有助于这组病人的临床诊治,更会促进对人体蛋白功能的理解。
感谢北京协和医院神经科管宇宙教授做的精彩解读。
本论文是非常经典的医学研究思路,先由临床患者发现潜在的候选致病(相关)基因,然后通过实验室研究进行功能验证。
原文题目是“Lipin 1 deficiency causes adult-onset myasthenia with motor neuron dysfunction in humans and neuromuscular junction defects in zebrafish”,于2021年发表于Theranostics。

摘 要
Lipin 1是一种细胞内蛋白,作为磷脂酸磷酸水解酶控制脂质代谢。人类LPIN1的隐性突变导致复发性、早发性肌红蛋白尿,这种情况通常与肌肉疼痛和无力有关。人体缺脂素1是否以及如何导致周围神经病变尚不清楚。一个成人发病的神经系统疾病,但没有肌红蛋白尿的家族中两个新的复合杂合突变的LPIN1被确认。
本研究旨在探讨LPIN1在肌肉和神经发育中的致病机制。
方法:
将先证者的临床诊断与已知的48例LPIN1隐性纯合突变进行比较。对综合征型肌无力家族进行全外显子组测序以确定致病基因。利用斑马鱼模型研究了体细胞发生和神经发生过程中脂素1缺乏的发病机制。采用原位杂交、免疫组织化学、双折射分析、触-唤起逃逸反应和运动实验等方法观察肌肉和神经元在体内的变化。通过siRNA敲除、药物治疗、qRT-PCR和Western blotting分析,在人原发胶质母细胞瘤和小鼠成肌细胞中评估Lipin 1调控的分子通路的保守性。
结果:
患者表现为成人性肌无力,伴有肌纤维萎缩和神经脱髓鞘,无肌红蛋白尿。在该家族中发现了两个新的杂合突变,即LPIN1中的C . 2047a >C (p.I683L)和C . 2201g >A (p.R734Q),并预测它们将改变Lipin 1蛋白的三级结构。通过注射lpin1 - morpholino基因或人lpin1基因突变的mRNA,在斑马鱼胚胎中产生的Lipin - 1缺失会产生肌切缺陷,初级运动神经元和次级运动神经元的投射减少,乙酰胆碱受体突触后簇的形态学改变,以及髓鞘形成缺陷。导致了触碰诱发反应的减少和游泳行为的异常。斑马鱼和哺乳动物细胞中Lipin 1功能的丧失也显示出肌肉和神经元标记物表达水平的改变,以及Notch信号异常增强,这些信号被特异性Notch通路抑制剂DAPT部分挽救。
结论:
这些发现指出,人类LPIN1的复合杂合突变导致成人发病综合征型肌无力并周围神经病变。此外,斑马鱼可以用于模拟由于Lipin 1缺乏而导致的神经肌肉表型,过度激活的Notch信号在哺乳动物细胞系中被发现并进一步证实了其新的病理作用。
立题及设计
科学假设:
LPIN1在肌肉和神经发育中的致病机制,人类LPIN1的复合杂合突变导致成人发病综合征型肌无力并周围神经病变。此外,斑马鱼可以用于模拟由于Lipin 1缺乏而导致的神经肌肉表型,过度激活的Notch信号在哺乳动物细胞系中被发现并进一步证实了其新的病理作用
研究类型:
回顾性,观察性,干预性(动物实验)
入组标准:
1)人类:
表现为成人型肌无力,伴有肌纤维萎缩和神经脱髓鞘,无肌红蛋白尿的家族(9例先证者),已知的48例LPIN1隐性纯合突变病例。
2)斑马鱼模型:
研究了体细胞发生和神经发生过程中脂素1缺乏的发病机制。采用原位杂交、免疫组织化学、双折射分析、触-唤起逃逸反应和运动实验等方法观察肌肉和神经元在体内的变化。通过siRNA敲除、药物治疗、qRT-PCR和Western blotting分析;
3)人原发胶质母细胞瘤和小鼠成肌细胞,评估Lipin 1调控的分子通路的保守性。
对照:
表现为成人性肌无力,伴有肌纤维萎缩和神经脱髓鞘,无肌红蛋白尿的家族中9例 vs 已知的48例LPIN1隐性纯合突变病例,5~24个 LP1N1基因敲除斑马鱼胚胎 vs 正常斑马鱼胚胎,基因敲除斑马鱼幼虫 vs 正常斑马鱼幼虫。
终点指标:
人类血清中LPIN1中基因型:的C . 2047a >C (p.I683L)和C . 2201g >A (p.R734Q),在斑马鱼胚胎中初级运动神经元和次级运动神经元的投射,乙酰胆碱受体突触后簇的形态学改变,以及髓鞘形成染色。斑马鱼幼虫触碰诱发反应和游泳行为的检测。
斑马鱼和哺乳动物细胞中肌肉和神经元标记物表达水平。
主要结果
1)一般生物学信息:
该家庭的先证者(II5)从27岁开始,持续了17年,在医院被诊断为肌肉无力和抽搐。实验室评估显示血肌酸磷酸激酶(CPK)偏高(22013 UI/L;正常<150 UI/L),谷丙转氨酶(ALT)和天冬氨酸转氨酶(AST)水平升高。骨骼肌活检显示肌纤维异常脂质超负荷,I型肌纤维占优势,II型肌纤维萎缩,肌纤维线粒体形态异常。此外,肌电图显示腓肠肌感觉神经传导速度减慢,上肢肌肉组织学分析显示神经源性损伤并严重神经脱髓鞘(表1)。先证者的大哥(II2)有类似症状。文献中48例LPIN1隐性纯合突变病例临床分析(略)。

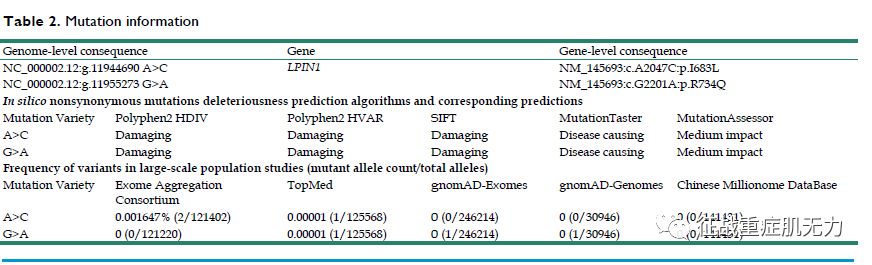
2)终点指标结果
①在病例II2和II5中发现了LPIN1的两个杂合突变(GRCh37 chr2: g.11944690)A >C,在dbNSFP中查询的硅预测算法预测了这两个杂合突变的破坏性和致病相关,两个突变的频率非常低。
② 进一步的动物模型验证
A)本研究采用斑马鱼模型。whole-mount ISH分析的时空表达模式显示,IHC染色显示lpin1蛋白特异性地定位于肌肉,以及50 hpf时的视网膜。lpin1在斑马鱼发育体和神经组织中具有丰富的特异性表达。注射lpin1 MO或过表达突变的人lpin1 mRNA,产生了lpin 1缺失的斑马鱼。
双折射的量化进一步显示注射lpin1 MO胚胎的II类(降低35%)和III类(降低58%)亮度显著降低,注射lpin1 MO的胚胎显示运动神经元轴突投射和AChR簇显著减少,lpin1 morphant(69.2±19.3μm, n = 9)比对照胚胎(161.0±16.6μm, n = 9) ,lpin1形态的AChR条纹的角度(102±8.8 o)比对照胚胎(84.4±6.6 o)增加了约20%,突触后密度的定量显示,lpin1形态的密度较对照降低了约44%。在lpin1变异体中,SMNs轴突信号强度非常弱,运动神经元长度增加,过早分支增加,未能到达腹侧肌节。在lpin 1形态中,AChR簇的密度大大降低。

lpin 1变种的斑马鱼幼虫与对照幼虫相比,少突胶质细胞和SCs中表达的GFP信号显著减少。与对照幼虫相比,lpin1变种的mbp荧光信号的定量也减少了70%。提示斑马鱼幼鱼lpin1功能的丧失导致了髓鞘损伤,这与我们的患者表型一致,神经组织学检查显示左侧腓肠有髓神经纤维明显减少,严重的神经脱髓鞘。qRT-PCR结果显示,lpin1斑马鱼胚胎形态在3dpf时,未成熟髓鞘形成标志物pou3f1的表达异常升高,成熟SCs标志物egr1、egr2a、egr2b和髓鞘标志物mpz的表达异常降低。


B)lpin 1缺陷斑马鱼幼虫与4只正常斑马鱼幼虫在接触5毫秒(ms)后迅速游走相比,lpin1变种表现出对接触的反应受损,甚至在20毫秒后也未能游离视野,联合注射lpin1 MO和人LPIN1wt mRNA挽救了受损的运动表型 300 s的累积持续时间记录表明,与对照幼虫(运动)相比,lpin1变种的运动时间显著减少(39.9±49.2 s),休息时间显著增加(259.9±49.1 s) ;hLPIN1wt mRNA联合注射的幼虫(3.15±1.13 mm/s),与对照组(4.17±1.34 mm/s)和lpin1 morphants的速度也显著降低(0.71±0.56 mm/s);lpin1形态幼虫与对照组(1686.5±26.8 mm)和获救幼虫(1402.9±22.3 mm)相比,平均游动距离(309.9±4.9 mm)显著降低。注射了LPIN1p的mRNA/I683L LPIN1p/R734Q或LPIN1p斑马鱼幼虫,与对照组和过表达LPIN1wt的幼虫相比,i683l和R734Q的移动速度和距离显著降低。
lpin 1变种体与对照胚胎相比,deltaC和deltaD的表达在前体细胞中胚层中扩大,在新形成的体中异常分布。lpin1变种与对照胚胎相比,50 hpf时中脑、后脑、间脑和脊髓中神经g1的表达明显减少,表明神经发生有缺陷。在50 hpf时,lrp4在斜唇和胸鳍的高表达也在lpin1形态中减少。与对照胚胎相比,通过isl1表达标记的脊髓中PMNs的形状和位置在25个hpf lpin1变种中发生了改变。此外,通过qRT-PCR分析发现,lpin1突变体中肌肉和神经元标记物的表达水平显著改变。

C)在哺乳动物细胞中敲低siRNA来模拟LPIN1的丢失。在小鼠成肌细胞C2C12和人原发性胶质母细胞瘤U87细胞中,LPIN1 siRNA达到了> 70%的敲低效率,导致肌肉和神经元标记物的异常表达水平。
D)Notch信号系统和LPIN1:在斑马鱼体内进行的双荧光素酶Notch报告基因检测表明,在lpin1缺失的胚胎中,Notch通路活性上调。这些结果表明斑马鱼的Notch活性受到Lpin1的负调控。
双荧光素酶报告法分析了I683L和R734Q对瞬时转染HEK293T细胞中Notch信号激活的影响。与斑马鱼的研究结果一致,HES1报告所测量的LPIN1能够显著抑制NOTCH信号。相反,携带I683L或R734Q,或同时携带I683L和R734Q的突变LPIN1消除了LPIN1对NOTCH信号活性的拮抗作用。

E)在HEK293T、人原发性胶质母细胞瘤U87、小鼠成肌细胞C2C12和人骨肉瘤U2OS细胞中对LPIN1进行siRNA敲除。在HEK293T细胞中,LPIN1 siRNA达到了> 65%的knockdown效率,NOTCH1水平在HEK293T、人原发性胶质母细胞瘤U87、小鼠成肌细胞C2C12和人骨肉瘤U2OS细胞中对LPIN1进行siRNA敲除。在HEK293T细胞中,LPIN1 siRNA达到了> 65%的knockdown效率,NOTCH1,NOTCH2, JAG1, JAG2和hes1显著增加。加入DAPT可以挽救NOTCH通路组分的异常增加。

结论:
在斑马鱼和哺乳动物细胞系中,LPIN1具有广泛的抑制NOTCH信号的活性,这可能是脂素1缺乏引起人类肌肉和神经元表型的病理机制,LPIN1可能通过AGRIN-LRP4-MuSk信号通路直接或间接参与NMJ的形成和功能。
编者按:
在临床工作中,经常会遇到原因不明的肌无力/肌病患者,其中很大一部分是由于基因突变所致。
电生理查明病变部位、肌肉活检检测其病理改变之外,有针对性地基因检测可能是确诊的重要方法。
对于Lipin 1缺陷相关肌病,本文做了非常好的研究。我们也找到了Lipin 1缺陷相关肌病的病理生理假说:

(The EMBO Journal (2019)38:e99576)
我们特别关注Lipin 1缺陷相关肌病的临床表现。可以看到,患者出现高肌酸激酶,同时,41.7%患者出现肌无力。
如下图所示:

(The EMBO Journal (2019)38:e99576)
期待通过管宇宙教授对于Lipin 1的解析,能够:
1,促进临床对于肌无力来诊患者的理解和鉴别诊断;
2,本文能够为临床科研的设计提供借鉴。
参考文献:
Lu S, et al. Lipin 1 deficiency causes adult-onset myasthenia with motor neuron dysfunction in humans and neuromuscular junction defects in zebrafish. Theranostics. 2021 Jan 1;11(6):2788-2805. doi: 10.7150/thno.53330.
本文转载自:Lipin 1缺乏相关的成年人发病肌无力,与神经肌肉接头障碍相关 (qq.com)


